-
产品及解决方案
-
服务
-
产品及解决方案
-
服务
-
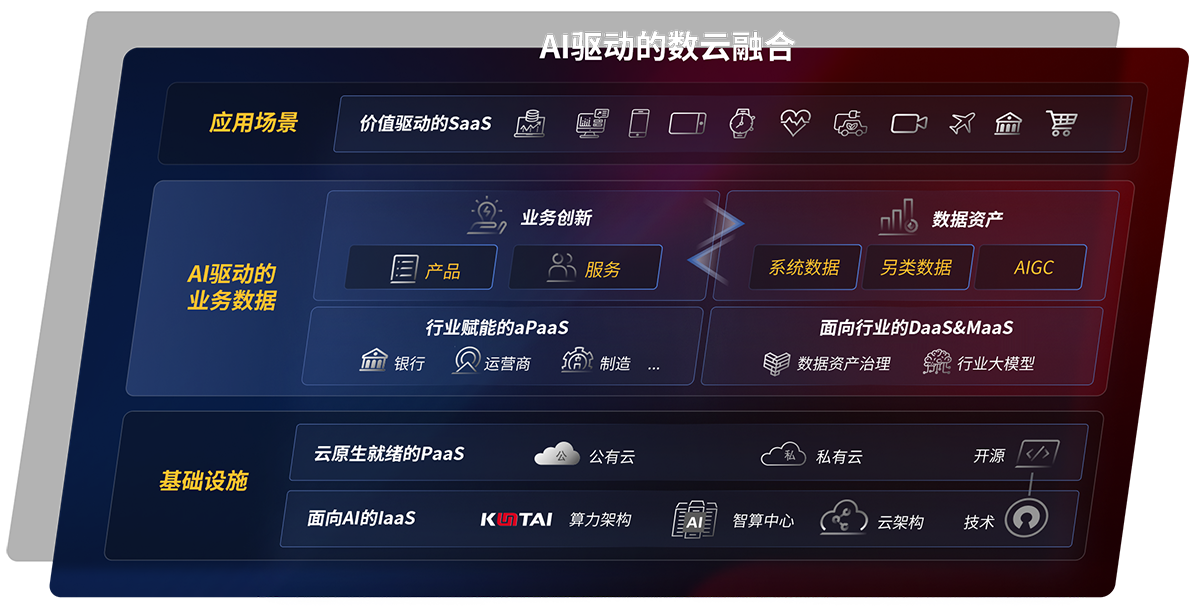
云原生产品及应用平台
- PG研云 研制一体化工业互联网解决方案
- 磐云 云原生PaaS平台
- PG云印 数字化文印管理平台
- PG视讯 融合会议服务平台及应用
-
云服务



































































 京公网安备 11010802037792号
京公网安备 11010802037792号

